PIC/Sの現状 GMP Technical Advisor 佐々木次雄
医薬品メーカー、医薬品製造の現場で重要となる「PIC/S」の現状について、分かりやすく解説いたします。

フォーム送信完了後、PDFファイルのダウンロード画面が表示されます。
本資料の構成
1.PIC/S加盟後
- PIC/Sの目的
- PIC/Sの目的(続)
- PIC/Sの活動とは?
- PIC/S加盟当局
- 43 の加盟国(46当局)2014年7月現在
- PIC/Sのゴール
- PIC/Sの組織
- 7つの専門委員会(議長は理事会委員の中から選ばれる)
- 新規導入又は改訂されたガイドライン
- PIC/Sガイドライン改訂
- PIC/S加盟国の利点
- PIC/S Seminars
- Expert Circles during 2015
- 加盟当局に求められること
- セミナー、エキスパートサークル
- 模擬査察演習
- GMP等適用施設数/監視員数
- GMP施行通知(2013.08.30)
2.製薬用水の製造管理
- GMP施行通知 第4 バリデーション基準
- WHO: Phase 1
- WHO: Phase 2
- WHO: Phase 3
- PIC/S Annex 1
- PIC/S Annex 1改正作業スケジュール
- 主な改正点
- 日本における注射用水の製法
- EPにおける注射用水の製法
- アンケート結果で得られた達成可能な数値(EDQM:2010年)
- ミネラルウォーターのTOC値(日局)
- Relationship between TOC and numbers of bacteria
- TOC in Pharmaceutical Waters
- 製薬用水の製造管理
3.PIC/S Guideline Annex 2
- Annex 2
- 改訂作業グループ
- EUにおける医療製品
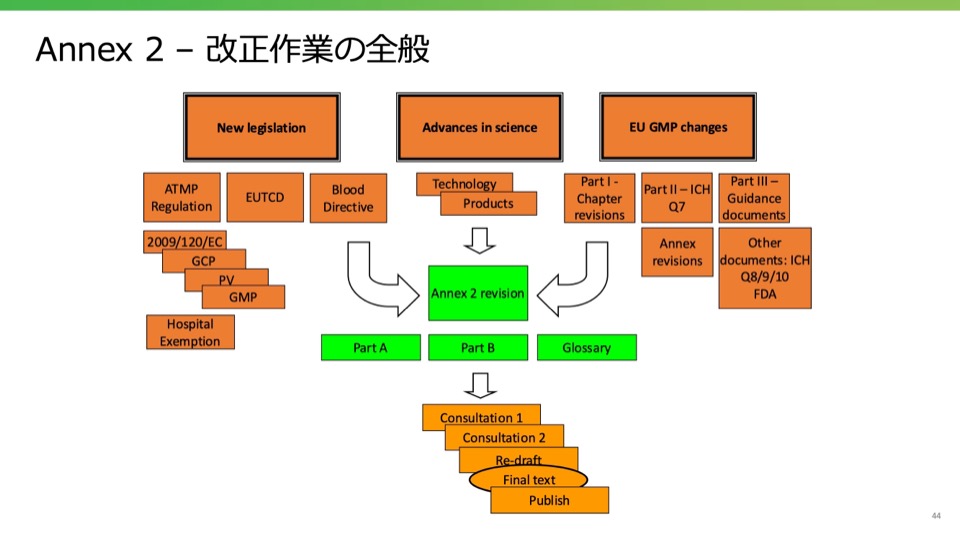
- Annex 2 – 改正作業の全般
- Annex 2の構成
- GMP適用の出発点
- 専用施設と設備の変更
- 芽胞取扱い施設に対するFDA規制 以前(21 CFR 600.11)
- 芽胞形成菌取扱い施設要件の緩和
- 規制緩和背景
- 薬局等構造設備規則(日本) 微生物取扱い作業所
- EU-GMP Part 1の構成
- 製造における交叉汚染の防止 EU-GMP Part 1, Chapter 5(2015.03.01より施行)
- 製造における交叉汚染の防止 EU-GMP 5.21(続)
- Scope⇒Table 1に変更
- Annex 2 の適用範囲 (表1)
- Part A: 一般ガイダンス * EUは70項目、PIC/Sは71項目
- 原則(2013年版)
- 従業員(2013年版)
- 建物と設備 専用施設
参考イメージ